近日,符雷蕾研究小组在药物化学领域Top期刊Journal of Medicinal Chemistry上发表综述《Targeting Extracellular Signal-Regulated Protein Kinase 1/2 (ERK1/2) in Cancer: An Update on Pharmacological Small-Molecule Inhibitors》2022; https://doi.org/10.1021/acs.jmedchem.2c0124. 必赢bwin线路检测中心为第一署名单位,符雷蕾副教授为文章第一作者,硕士研究生陈思伟为第二作者,四川大学华西医院的陈亿教授和生物治疗国家重点实验室的刘博教授为共同通讯作者。

众所周知,RAS-RAF-MEK-ERK (MAPK)信号通路是将来自细胞因子、激素、细胞应激等胞外信号传导入胞内的重要信号通路,其失调与多种人类癌症的异常激活和不良预后都紧密相关。在MAPK中,ERK作为上游信号的效应激酶处于信号传导的关键位置——上游信号经由RAS-RAF-MEK-ERK信号级联依次传递,激活后的ERK从细胞质转移至细胞核,从而激活多种与细胞增殖、分化、迁移和血管生成相关的底物。RAS、RAF、MEK突变激活被发现普遍存在于人类癌症中,这些上游突变均可导致ERK的过度激活,并持续激活ERK下游底物,导致肿瘤细胞的增殖、分化和转移。目前,已有多种靶向RAS、RAF突变的药物被批准用于癌症治疗,但长期治疗产生获得性耐药降低了这些药物的疗效。
ERK有两种亚型(ERK1和ERK2),它们84%的氨基酸残基相同。ERK1/2具有典型的蛋白激酶特征结构双叶型折叠,通过磷酸化底物对细胞生命活动进行调控。其N端结构结合ATP以定位其β和γ磷酸基团,而C端结构则催化ATP的磷酸基团转移到ERK1/2的底物上。细胞因子、激素和细胞应激等胞外信号通过多种跨膜受体进入细胞,并沿RAS-RAF-MEK-ERK传递到细胞内,从而调控细胞的重要生命活动。在这个过程中,ERK1/2是MEK的唯一底物,却可以磷酸化数百种下游细胞质和细胞核底物,可见其在胞外信号向胞内传递过程中的重要性。
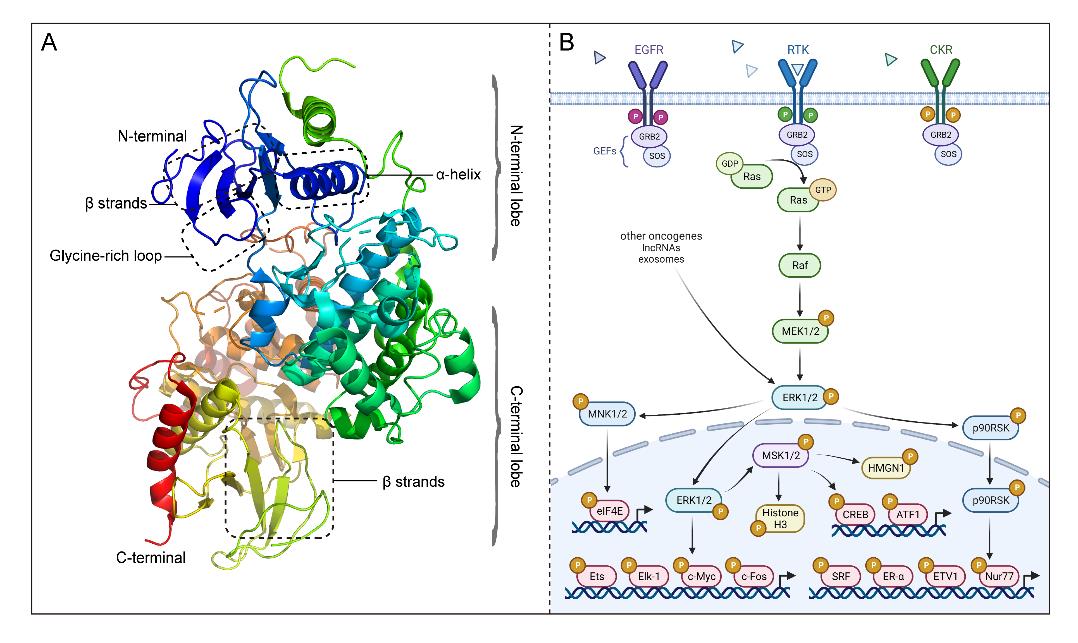
图 1. ERK1/2的分子结构及其关键调控通路
MAPK信号通路的异常激活在大约三分之一的癌症中被发现,其成员作为改善癌症治疗的潜在药物靶点已引起越来越多的关注。迄今,一些RAF和MEK抑制剂已获批用于癌症治疗,但长期用药不可避免地产生耐药性,导致疗效降低。鉴于这一局限性,选择性抑制ERK1/2可能被视为一种有前景的治疗策略: 有效阻断癌细胞中的MAPK通路并克服癌细胞对RAF和MEK抑制剂的耐药性。近年来,许多靶向ERK1/2的小分子化合物被开发用于癌症的临床前和临床研究。近日,必赢bwin线路检测中心符雷蕾研究小组就ERK1/2的结构特征、调控关键上下游通路及其抗肿瘤靶向ERK1/2的单靶、双靶向小分子化合物,并从体内外活性、选择性、构效关系等角度进行阐述。
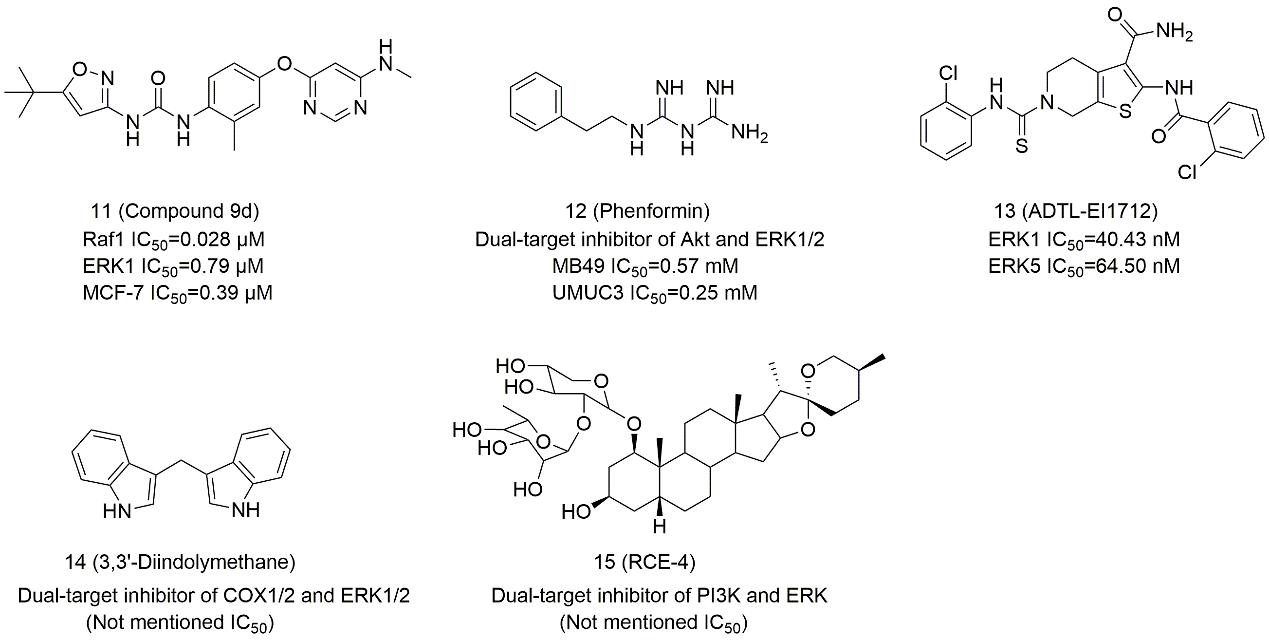
图2. 靶向(单靶标)ERK1/2的小分子抑制剂
符雷蕾副教授长期从事靶向ERK1/2的小分子抑制剂的发现及其抗肿瘤作用机理研究。以通讯作者发表相关学术论文多篇(Oncotarget. 2017 Oct 26; 8(61):104193-104205. Eur J Med Chem. 2017 Feb 15; 127:997-1011. J Med Chem. 2020 Apr 23; 63(8):3976-3995. 封面故事);这些工作相继报导了多个具有成药潜力的靶向ERK1/2的小分子抑制剂。
论文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.2c01244
