近日,国际生物医学、化学、物理学和材料学领域权威期刊《Small Methods》(影响因子15.367)报道了我校“微纳生物技术”创新团队孟涛教授的研究成果“Bacteria-Inspired Aqueous-in-Aqueous Compartmentalization by In Situ Interfacial Biomineralization”中文译名:“受细菌启发的全水隔室界面原位仿生矿化”(DOI: 10.1002/smtd.202201309)。论文第一作者为必赢bwin线路检测中心苑昊老师和2018级硕士研究生李飞,通讯作者为深圳大学生物医学工程学院孔湉湉副教授和必赢bwin线路检测中心孟涛教授,必赢bwin线路检测中心为第一署名单位。
在自然界中,细胞通过隔室化富集生物分子并控制关键分子进出以进行高效催化及有序生化反应。模拟细胞隔室,在水相环境中可构建全水生物隔室,并由于其具有高生物相容性及与细胞环境高相似度,已被广泛应用于药物递送、探索细胞反应机制等领域。然而全水生物隔室界面张力低,难以稳定。即使目前已有特定颗粒可吸附在界面以稳定全水隔室,但由于界面吸附过程具有随机性并受局部环境流体性质影响,导致产生的全水隔室界面性质不可控,影响全水隔室对生物分子的包封与递送。受细菌通过尿素分解通路在其自身表面形成碳酸钙颗粒的启发,并基于本课题组近年来在全水相界面生物反应及功能材料创制(AIB)方向的工作积累(Chemical Engineering Journal, 2023, 454, 140276; ACS Applied Materials & Interfaces, 2022, 14(4), 5009-5016; Bioresource Technology, 2021, 342, 126019; ACS Applied Materials & Interfaces, 2019, 11(40), 37313-37321; Chemical Engineering Journal, 2018, 335: 392-400; ACS Macro Letters, 2017, 6(7): 679-683.),作者提出在全水隔室界面原位仿生矿化产生碳酸钙颗粒,以长时间稳定全水隔室。通过在界面原位形成碳酸钙颗粒,避免了颗粒随机吸附并不受局部流体环境干扰,实现了全水隔室性质的有效调控,稳定时间可达无碳酸钙颗粒覆盖的全水隔室的90倍(图1)。并且,以此全水隔室为模板制备的药物递送体系提供了酸响应性,可在胃部环境实现生物药物快速释放,用于治疗消化功能紊乱等相关疾病(图2)。此研究为全水隔室制备提供了通用且可控的策略,为生物药物保存与递送提供全新平台;通过将水性两相系统与生物矿化结合,开辟了通往下一代自组装材料和结构的新途径。据悉,该研究成果正与生物技术企业开展成果转化,共同推进其在药物递送领域的应用。
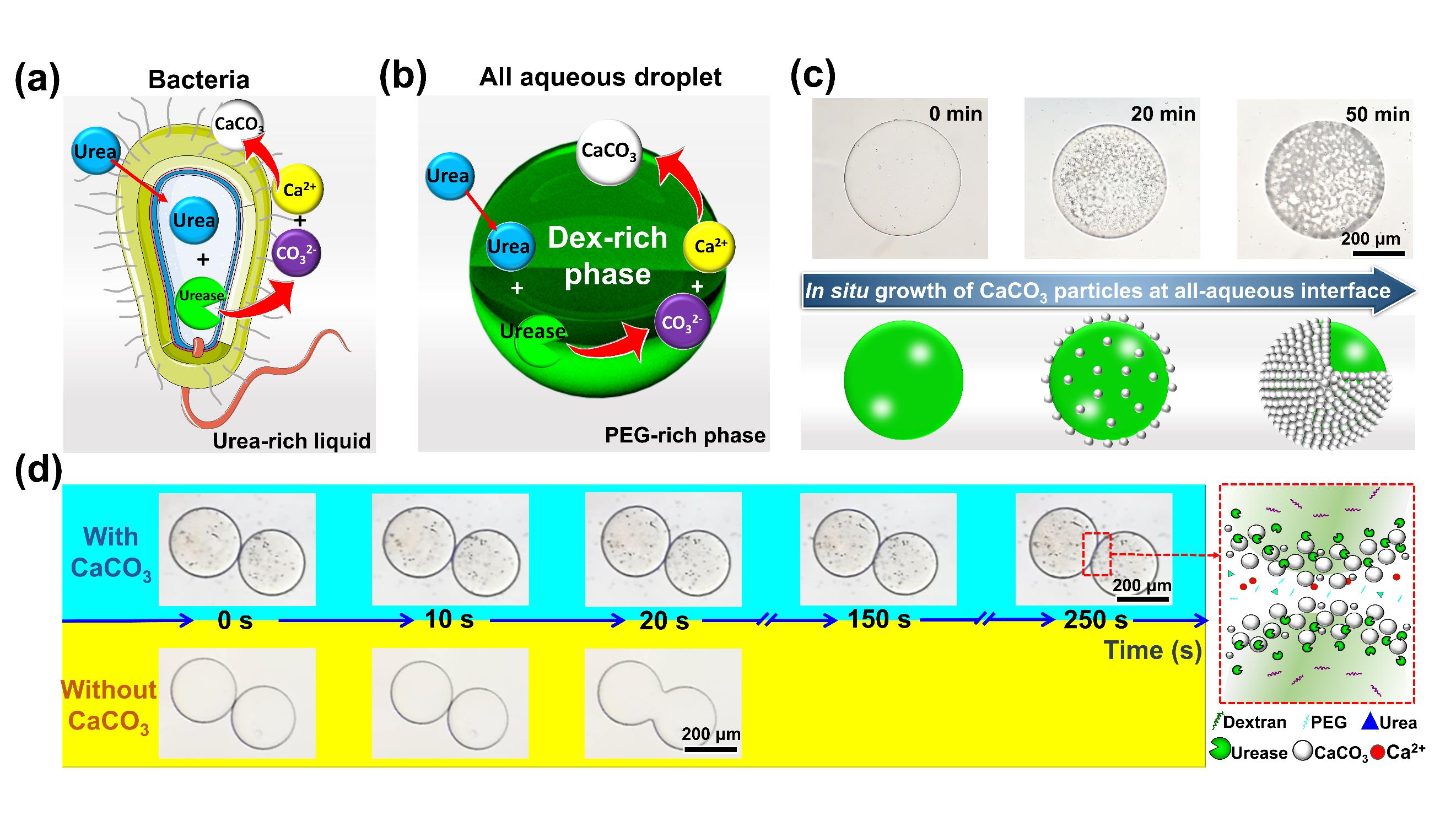
图1 受尿素分解细菌启发,构建碳酸钙颗粒稳定的全水隔室及其与无碳酸钙颗粒的全水隔室聚并时间对比。

图2 以碳酸钙颗粒稳定的全水隔室为模版构建药物递送微囊及其在生物活性物质包封、酸性环境药物释放的应用。
本研究受到国家自然科学基金项目(21776230, 52172283),四川省科技厅重点研发项目(2020YFG0092, 2021YFN0129),中央高校基础研究基金(2682021ZTPY031, 2682021CX087)的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/smtd.202201309

必赢bwin线路检测中心“微纳生物技术”创新团队介绍:
以孟涛教授、邱忠平教授、廖海副教授、黄新河副教授、郭婷高工、王垚磊博士、李加洪博士、苑昊博士为主的科研团队聚焦微纳米尺度下生物反应和药物递送等重大问题,一直倡导将前沿性基础研究成果与国民经济发展和国家重大需求紧密相连。在以下方面开展科研工作:(1)微纳米尺度的生物反应分离、(2)微流控液滴技术的生命分析、(3)微纳米药物缓控释技术研究、(4)微纳米农业和环境生物技术。目前课题组正承担多项国家自然科学基金项目、省部级重点研发项目和企业合作课题。已发表高水平学术论文100余篇,申请国家发明专利50余项,并开展工业生物技术转化。

